√Hukum Hess
Namanya juga mencari informasi, tentu dibutuhkan keterbukaan dari Anda, dalam artian bahwa apa yang akan kami jelaskan disini tentu membutuhkan sedikit waktu dalam membacanya baru bisa memahaminya. Untuk itu buka lebar-lebar pikiran Anda supaya dapat menangkap "pengetahuan" baru yang akan kami bahas sebentar lagi. Berikut penjelasannya.
Pembahasan Lengkap Hukum Hess
Hukum Hess – Hay sahabat semua.! Pada perjumpaan kali ini, kembali akan kami sampaikan materi tentang Hukum Hess – Pengertian, Rumus, Bunyi, Penerapan dan Contoh Soal Beserta Jawabannya.
Hukum Hess adalah salah satu topik yang paling menarik dalam pelajaran ilmu kimia yang banyak disukai oleh sejumlah pelajar dan hampir semua pendidikan.
Apa Itu Hukum hess?
Hukum Hess adalah hukum kimia fisik untuk ekspansi Hessian dalam siklus Hessian. Hukum ini digunakan untuk memprediksi perubahan entalpi dari hukum kekekalan energi (dinyatakan sebagai fungsi keadaan H).
Nah untuk melengkapi apa yang menjadi tema pembahasan kita kali ini, sebainya kalian langsung saja simak ulasan selengkapnya di bawah ini.
Pengertian Hukum Hes

Apa yang dimaksud dengan hukum hess ? yakni merupakan sebuah hukum yang ada di dalam kimia fisik untuk ekspansi Hess dalam siklus Hess.
Dimana jenis Hukum ini berfungsi untuk memprediksi suatu perubahan entalpi yang terjadi dari hukum kekekalan energi (yang kemudian dinyatakan sebagai fungsi kondisi ΔH).
Selain itu Hukum ini juga kerap dipakai guna menentukan jumlah entalpi secara menyeluruh akan proses reaksi kimia meskipun dengan memakai rute reaksi yang berbeda.
Kemudian Entalpi ialah merupakan fungsi kondisi, dimana perubahan entalpi dari suatu reaksi kimia ialah sama, meskipun pada sejumlah langkah yang dipakai untuk mendapatkan produk berbeda.
Selain itu hukum ini juga merupakan suatu hukum yang memiliki keterkaitan kimia fisika yang diusulkan sudah sejak tahun 1840 oleh salah seorang yang bernama Germain Hess, seorang kimiawan yang berasal dari Rusia kelahiran Swiss.
Kemudian perubahan entalpi yang terjadi pada suatu reaksi bisa dihitung meskipun tidak dapat di ukur secara langsung.
Nah cara yang digunakan untuk mengukurnya ialah denagan cara melakukan suatu operasi aritmatika di sejumlah persamaan reaksi yang perubahannya bisa di ketahui.
Apabila pada suatu persamaan reaksi di kalikan maupun di bagi dengan suatu angka, maka selanjutnya pada perubahan entalpi juga musti di kali atau harus di bagi juga. Demikian juga apabila persamaan di balikan maka perubahan entalpi juga di balik.
Bunyi Hukum Hess
Nah di bawah ini ialah merupakan bunyi hukum hes:
Jumlah panas yang diperlukan atau keluarkan pada suatu reaksi kimia tidak sama sekali bergantung pada jalannya reaksi namun ditentukan oleh kondisi awal dan akhir.
Kegunaan Hukum Hess
Adapun fungsi dari hukum Hes ialah guna memprediksi adanya suatu perubahan entalpi dari hukum kekekalan energi yang mana hal ini dinyatakan sebagai fungsi kondisi ΔH.
Kemudian Hukum Hes juga bisa dimanfaatkan guna menghitung jumlah entalpi secara menyeluruh atas proses reaksi kimia meskipun memakai rute reaksi yang berbeda.
Penerapan Hukum Hess
Di bawah ini ini terdapat beberapa keterangan mengenai penerapan hukum hes, yang diantranya ialah sebagai berikut:
- Langkah yang dapat kita ambil yakni dengan cara mengkombinasikan sejumlah reaksi yang apabila sudah diketahui entalpinya untuk mendaptkan entalpi reaksi yang akan kita cari.
- Adanya Kebalikan dari pada sautu reaksi menyebabkan terjadinya perubahan tanda entalpi, maknanya apabila suatu reaksi berjalan denganb secara eksoterm maka pada kebalikan reaksi itu ialah endoterm dengan menggunakan tanda entalpi yang saling berlawanan.
- Apabila suatu reaksi dikalikan oleh suatu bilangan maka entalpi reaksi itupun pula musti dikalikan dengan bilangan yang sama.
Rumus Hukum Hes
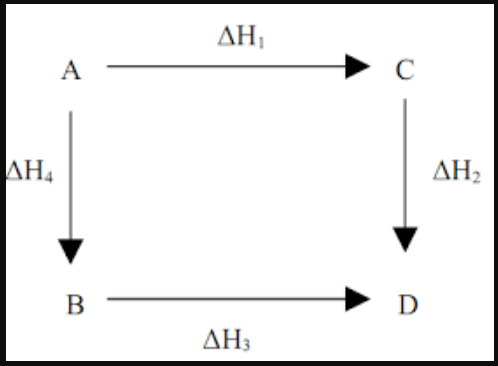
(ΔH 1 +ΔH 2 = ΔH3 +ΔH4 )
Apabila kalian perhatikan pada gambar di atas, dimana mereaksikan A dengan D bisa dengan cara menempuh jalur B dan C. Dengan cara merubah entalpi yang sama
Apabila perubahan kimia tersebut berlangsung pada sejumlah jalur yang berbeda, maka perubahan entalpi dari semuanya juga akan sama. Dengan begitu ΔH untuk reaksi tunggal bisa di rumuskan sebagai berikut:
ΔH reaksi= ∑ ΔH f (produk) ∑ ΔH f (reaktan)
Contoh Soal Hukum Hes dan Jawabannya
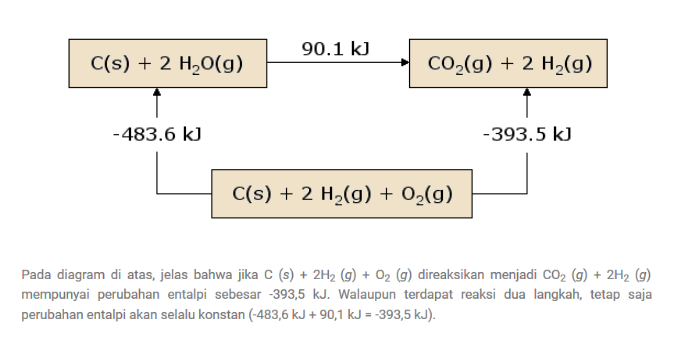
Hitunglah dan tentukanlah berpakah jumlah kalor yang dikeluarkan/bebasakan pada ketika terjadi suatu pembakaran 1 mol Hindrokarbon C²H² (mr=26) jika telah diketahui bahwa entalpi jumlah pembentukan H ² O(g)=-285Kj/mol, Kemudian CO² (g) mol/Kj dan selanjutnya C²H²(g)=+227mol/Kj
Pembahasan :
Langkah awal yang dapat kita kerjakan ialah membentuk sebuah persamaan reaksi guna pembakaran C²H² .
Namun hal yang harus kalian pemhami mengenai istilah pembakaran ini disini bermaknakan suatu senyawa yang direaksikan dengan sebuah oksigen(O²).
Kemudian dari rekasi hidrokarbon biasanya dapat selalu memperoleh hasil yakni karbondioksida dan juga uap air.
Nah apabila sudah disetarakan maka kemudain akan memperoleh sebuah hasil persamaan reaksi, yakni sebagai berikut
C²H²+5/2O²(g)→2CO²(g)+H²O
- ΔHreaksi=ΔH hasil-ΔH pereaksi
- ΔHreaksi=2ΔHfCO²+ΔHf H²O-ΔHfC²H²-5/2ΔHf O²
- ΔHreaksi=2(-393)+(-285)-227-5/2(0)
- ΔHreaksi=-1298kj/mol
Namun harus di ingat bahwa ΔH ialah merupakan suatu unsur yang bernilai 0 sehingga ΔH f O ² = 0
Nah itulah yang bisa quipper.co.id sampaikan mengenai Hukum Hess, semoga serangkaian materi yang telah quippr.co.id jabarkan kali ini dapat bermanfaat untuk sahabat semua.
The post Hukum Hess appeared first on Quipper.Co.Id.
Itulah tadi ulasan tentang Hukum Hess yang dapat kami sampaikan untuk Sobat pembaca semuanya. Tak lupa kami ucapkan banyak terima kasih karena sudah mengunjungi situs quippercoid. blogspot. com dan membaca urian diatas hingga selesai. Semoga apa yang kami sampaikan diatas dapat menambah wawasan kita semuanya, tertama untuk Anda yang memang sedang mencarinya. Ingat untuk selalu bahagia dan sampai jumpa di postingan selanjutnya.
Post a Comment for "√Hukum Hess"